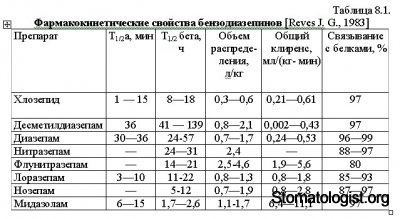
В соответствии с принятой в настоящее время классификацией производные бензодиазепина подразделяются на три группы в зависимости от периода полувыведения. К соединениям, характеризующимся длительной элиминацией (Т1/2бета более 24 ч), относятся хлозепид (хлордиазепоксид, элениум), диазепам (седуксен, реланиум, сибазон), мезапам (рудотель), нитразепам (эуноктин, родедорм). В группу препаратов со средней длительностью элиминации (Т1/2бета=5 — 24 ч) входят нозепам (оксазепам, тазепам) и проходивший в клиническую апробацию флунитразепам. Наконец, представителем препаратов с коротким периодом полувыведения (Г1/2бета менее 5 ч) является завоевавший популярность в западных странах мидазолам.
Ограничимся указанием основных фармакокинетических свойств перечисленных препаратов (табл. 8.1). Из приведенных данных привлекают внимание два факта. Вопервых, как уже было указано, диазепам относится к числу медленно выделяющихся из организма препаратов. Естественно, это ухудшает управляемость оказываемым им действием даже в том случае, когда его вводят внутривенно. Отмеченного недостатка почти лишен короткодействующий препарат мидазолам, интерес к которому обусловлен именно возможностью управления эффектом: период его полувыведения в 15—20 раз меньше, чем диазепама, а общий клиренс превышает этот показатель диазепама в 20—30 раз. Вовторых, продукт метаболической переработки диазепама — десметилдиазепам — дает фармакологический эффект и медленно выделяется из организма. На фармакокинетику бензодиазепинов влияет множество факторов: возраст, пол, нарушение работы ферментных систем, заболевания почек, печени и др.
Наркотические анальгетики занимают важное место в арсенале средств, используемых в анестезиологии, что, естественно, повышает интерес к фармакокинетике этих препаратов. Изучение их действия осложняется рядом обстоятельств (многообразие путей введения, несовершенство методов определения концентрации анальгетиков и др.), что позволяет представить картину лишь ориентировочно. Мы сосредоточим основное внимание на внутривенном пути введения как наиболее целесообразном при использовании этих средств с целью анестезии.
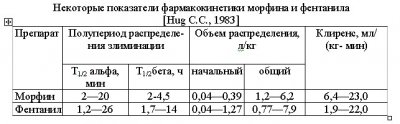
Для иллюстрации кинетики анальгетиков мы выбрали наиболее популярные препараты — морфин и фентанил.
Определенные различия в фармакокинетике препаратов объясняются их жирорастворимостью. Обладающий высокой растворимостью в липидах фентанил быстро проникает через мембраны в ЦНС и столь же быстро ее покидает, что проявляется присущим этому анальгетику кратковременным эффектом. Морфин, будучи менее липофильным, проникает в ЦНС медленнее, хотя некоторые центральные проявления действия препарата (например, угнетение дыхания) становятся заметны почти сразу же после внутривенной болюсной инъекции. Вместе с тем хорошая растворимость фентанила в жирах (соотношение жир/плазма для фентанила составляет 35:1, а для морфина только 0,8:1) обусловливает его длительное депонирование в жировых депо, из которых он выделяется довольно медленно. В связи с этим он имеет относительно длительный период полуэлиминации (T1/2бета 2 — 5 ч).
Необходимо учитывать влияние на фармакокинетику наркотических анальгетиков еще одного фактора — ионизации. Будучи слабыми основаниями, они подвергаются заметной ионизации (морфин при рН 7,4 ионизирован на 23%, а фентанил — на 9%). Более высокая степень ионизации снижает жирорастворимость, уменьшает связывание с белками (свободная фракция морфина в плазме составляет 70%, а фентанила только 9%), влияет на распределение между плазмой и другими жидкостными секторами организма, уменьшает реабсорбцию в почках и этим способствует выделению части препарата в неизмененном виде. Однако влияние на фармакокинетику всех перечисленных физикохимических свойств анальгетиков в определенной степени ослабляется высоким объемом распределения (VD).
Биотрансформация наркотических анальгетиков в печени служит наиболее важным механизмом их элиминации, причем метаболиты выводятся главным образом почками. Так, конъюгация морфина с глюкуроновой кислотой обусловливает основной путь его метаболических превращений. Это соединение фармакологически мало активно и довольно легко выделяется почками. Однако при почечной недостаточности морфина глюкуронат накапливается в организме, может проникать и депонироваться в ЦНС и давать некоторый фармакологический эффект. В отличие от морфина метаболиты фентанила не обладают фармакологической активностью. Фентанил может быть использован без какихлибо последствий у больных с почечной недостаточностью. Особенности распределения, метаболизма и элиминации наркотических анальгетиков представлены в таблице.
Разброс данных отражает различия в исследованиях, проведенных у здоровых и больных разного возраста в неодинаковых клинических условиях на фоне применения различных доз препаратов. На эти показатели существенно влияют оперативные вмешательства, искусственное кровообращение, колебания гемодинамики (соответственно перфузии органов и тканей), функциональное состояние печени и почек и т.д. Учет всех этих факторов необходим для объективного анализа фармакокинетики наркотических анальгетиков, отражающейся на их фармакологическом эффекте.
Мышечные релаксанты. В целом их фармакокинетика подчиняется тем же механизмам, что и этот процесс у других лекарственных средств. Количество миорелаксанта, достигающее нервномышечного соединения, зависит от содержания свободной формы препарата в крови. Поскольку мышечные релаксанты вводят внутривенно, их концентрация в крови обусловлена дозой и скоростью введения, связыванием с белками, особенностями распределения и элиминации.
Элиминация мышечных релаксантов из организма происходит тремя основными путями. Дитилин — единственный мышечный релаксант, который почти полностью подвергается метаболической трансформации в плазме. Панкуроний метаболизируется частично. Тубокурарин полностью выделяется из организма неизмененным. Как неизмененные формы препаратов, так и их метаболиты элиминируются из организма через почки и с желчью. Существуют и другие малоизученные пути выделения мышечных релаксантов экзокринными железами (главным образом слюнными), депонирования в тканях.
На скорость накопления мышечных релаксантов в нервномышечном соединении влияет несколько факторов Кровоснабжение нервномышечного синапса существенно выше, чем мышц в целом. Переход миорелаксанта из кровотока в нервномышечное соединение почти не встречает сопротивления Наконец, достижение мышечным релаксантом постсинаптической мембраны и, возможно, двигательной пластинки требует только распределения во внеклеточном пространстве и не нуждается в прохождении через клеточную мембрану.
Быстрая афаза падения концентрации миорелаксанта в крови зависит главным образом от распределения его в тканях. Бетафаза определяется в основном экскрецией препарата с мочой и желчью (для тубарина Т1/2 бета составляет 1,3—2,9 ч, для панкурония — 1,6—2,4 ч). Поскольку мышечные релаксанты высокоионизированы, они с трудом проникают через клеточные мембраны и поэтому имеют небольшой объем распределения (начальный VD равен 0,08— 0,14 л/кг, а при достижении устойчивого состояния VD составляет 0,2— 0,45 л/кг). Клиренс панкурония достигает 1 — 1,9 мл/(кгмин), а тубокурарина — 1,8—3,8 мл/(кг мин).
На клинический эффект мышечных релаксантов влияют такие фармакокинетические факторы, как экскреция с мочой (замедление экскреции при почечной недостаточности), элиминация и биотрансформация печенью (при печеночной недостаточности этот процесс может быть продолжительным), возраст (уменьшение клиренса панкурония из плазмы у пожилых людей и повышенная чувствительность новорожденных к тубокурарину), гипотермия (удлиняет действие антидеполяризующих релаксантов).
Фармакокинетика деполяризующих мышечных релаксантов, в частности дитилина, мало изучена. Хорошо известен лишь механизм биотрансформации препарата, псевдохолинэстераза вызывает его распад до сукцинилмонохолина, а затем до сукциновой кислоты и холина. Довольно широко распространено мнение, что нервномышечный блок, вызываемый дитилином, прекращается благодаря этому процессу метаболических превращений. Подобная точка зрения ошибочна. В действительности метаболическая трансформация препарата в плазме определяет лишь его количество, которое достигает нервномышечного соединения. Прекращение нервномышечной блокады происходит главным образом благодаря вымыванию дитилина из нервномышечного соединения. Короткое парализующее действие этого миорелаксанта обусловлено быстрым исчезновением его из плазмы в результате как биотрансформации, так и перехода во внесосудистое пространство. Выделение дитилина с мочой составляет менее 10% введенной дозы и мало влияет на кинетику элиминации.
СПИСОК ЛИТЕРАТУРЫ
Закусов В.В., Комиссаров И.В., Синюхин В.Н. Общая фармакология // Клиническая фармакология / Под ред. В.В. Закусова.— М., 1978.— С. 22—63.
Соловьев В.Н., Фарсов А.А., Фишман В.М. Фармакокинетика.—М.: Медицина, 1980.
Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика: Руководство.— М.: Медицина, 1985.
Gibaldi М., Levy G. Pharmacokinetics in clinical practice, a. Applications//J. A. M. A.— 1976.—Vol. 235, N 18.—P. 1987—1992.
Hug С.С. Pharmacokinetics and dynamics of narcotic analgesics // Pharmacokinetics of anaesthesia / Ed. C. PrysRoberts, С.С. Hug.— Oxford, 1983.— P. 187—234.
Hull C.J. General principles of pharmacokinetics // Pharmacokinetics of anaesthesia / Ed. C. PrysRoberts, C. C. Hug.—Oxford, 1983.—P. 1—24.
Mapleson W. W. Pharmacokinetics of inhalation anaesthetics. // Pharmacokinetics of anaesthesia / Ed. C. PrysRoberts, C. C. Hug.—Oxford, 1983.—P. 89—111.
Miller R. D. Pharmacokinetics of muscle relaxants and their antagonists // Pharmacokinetics of anaesthesia / Ed. C. PrysRoberts, C. C. Hug.—Oxford, 1983.—P. 246269.