Дети старшего возраста более спокойно реагируют на обстановку операционной, более контактны и спокойно переносят венепункцию и внутривенное введение катетера перед началом индукции. Все же в ряде случаев у детей на операционном столе могут появиться беспокойство и негативизм, что требует быстрого начала индукции. В таких случаях, если есть возможность, следует быстро ввести внутривенно диазепам, миорелаксант и анальгетик.
Если вена еще не пунктирована, то через маску начинают подавать фторотан в сочетании со смесью закиси азота и кислорода (1:1). Однако лучше быстро сделать внутримышечную инъекцию кетамина (6—8 мг/кг). После этого уже в спокойной обстановке выполняют канюляцию вен, налаживают необходимый мониторный контроль.
Обычно при индукции медленно внутривенно вводят диазепам с панкуронием или с тубокурарином (тестдоза) и фентанилом, затем дитилин, после чего выполняют интубацию.
При поддержании анестезии и ИВЛ у детей важную роль играют увлажнение и температура дыхательной смеси Обязательно введение зонда в желудок, особенно маленьким детям, если используются интратрахеальные грубки без манжеток. Давление в дыхательных путях не должно превышать 2 кПа (20 см вод. ст.). Параметры ИВЛ устанавливают на аппарате, исходя из данных предоперационного исследования внешнего дыхания или ориентируясь по номограмме для детей. Большое значение имеет четкий контроль за температурой тела, так как дети быстрее охлаждаются и крайне неблагоприятно реагируют на быстрое согревание.
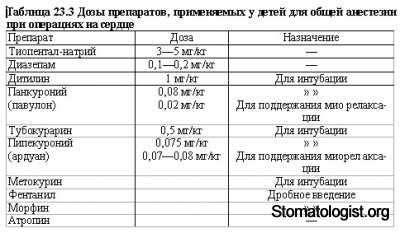
Легкую степень анестезии поддерживают с помощью фторотана в небольших дозах, сочетая его с закисью азота либо фентанилом, панкуронием или тубокурарином и диазепамом. Дозы препаратов, применяемых для анестезии, указаны в табл. 23.3.
Характерным аспектом патофизиологии порока являются шунтирование крови через дефект, обструкция выходного отдела желудочка или сочетание этих проявлений врожденной аномалии сердца. Шунтирование крови через дефект слева направо или же справа налево обусловливает степень увеличения или уменьшения легочного кровотока.
Сброс крови справа налево характеризуется определенной степенью выраженности цианоза и эритремии. Дефекты с уменьшенным легочным кровотоком и цианозом характерны для тетрады Фалло, трикуспидальной и легочной атрезии. Известно, что уменьшение легочного кровотока и повышение давления в легочной артерии происходит в норме под влиянием повышения давления в воздухоносных путях, понижении РаО2 и уменьшении рН. У больных с обедненным легочным кровотоком при ИВЛ следует акцентировать внимание на этом, так как значительное повышение давления на вдохе может еще больше снизить легочный кровоток и увеличить шунтирование крови через дефект (в частности, при тетраде Фалло).
Следует отметить, что снижение легочного кровотока удлиняет время наступления эффекта ингаляционных анестетиков, делает их применение менее управляемым. Между тем препараты, вводимые внутривенно, быстрее достигают головного мозга, так как практически минуют легочную циркуляцию. Напротив, у больных с увеличенным легочным кровотоком, с гиперволемией малого круга кровообращения кислород и ингаляционные анестетики быстрее диффундируют в легкие. Гемодинамика этих больных более устойчива к положительному давлению в воздухоносных путях при ИВЛ.
При пороках с выраженной обструкцией выходного отдела желудочков развивается гипертрофия миокарда, уменьшаются полости желудочков сердца. I При проведении анестезии у больных этой категории следует учитывать большую чувствительность миокарда к аноксии, а также проявлять осторожность при применении фармакологических средств, дающих кардиотонический; эффект (изадрин, дофамин, адреналин, строфантин и др.). Названные препараты увеличивают тонус гипертрофированного миокарда, вследствие чего еще больше уменьшаются полости желудочков сердца и увеличивается субвальвулярное стенозирование выходного отдела.
При дефектах перегородок сердца часто можно наблюдать нарушение проводимости, поэтому во время операции чаще возникают различного рода аритмии, блокады проводящих путей. Это связано с тем, что аномалия развития перегородок сердца нередко сопровождается нетипичной локализацией проводящих путей, которые в той или иной степени могут быть травмированы при коррекции порока. Все это может потребовать применения электрокардирстимуляции в течение определенного времени после коррекции порока.
Все сказанное о специфике анестезиологического пособия при хирургии врожденных пороков сердца еще раз подчеркивает положение о том, что, только имея четкие представления о патофизиологии врожденного порока, анестезиолог может внести ввесомый вклад в успех хирургического вмешательства на сердце. Мы коротко остановимся на характеристике основных пороков, указав отдельные специфические особенности тактики анестезиолога при каждом из них.
Дефект межпредсердной перегородки. В зависимости от расположения дефекта и особенностей его эмбриологического развития различают дефект первичной и вторичной перегородки.
Дефект первичной межпредсердной перегородки, как правило, находится над атриовентрикулярными клапанами и часто сочетается с патологией их развития (расщепление створки митрального клапана и др.).
Вторичный дефект межпредсердной перегородки может быть расположен в центральном ее отделе, в задненижнем, ближе к усгью нижней полой вены или около устья верхней полой вены. Иногда он может представлять собой сочетание нескольких небольших дефектов.
Дефект межпредсердной перегородки характеризуется шунтированием крови из левого предсердия в правое, что ведет к увеличению минутного объема в малом круге кровообращения (гиперволемия малого круга) и увеличению функциональной нагрузки правого желудочка. Однако повышение давления в легочной артерии и развитие склероза сосудов малого круга наблюдается только в поздних стадиях существования порока. Обычно данный порок сопровождается невысоким общим сопротивлением легочных сосудов, в то время как артериовенозный сброс крови может быть высоким.
Клинические признаки порока довольно разнообразны и часто выражены слабо. Как правило, основной жалобой является одышка при физической нагрузке. При аускультации определяется систолический шум во втором — третьем межреберье справа от грудины. Шум обычно умеренный, не грубый. На ЭКГ выявляется преобладание электрической активности правого желудочка (правограмма). Часто наблюдается блокада правой ножки предсердножелудочкового пучка. На рентгенограмме грудной клетки видны признаки гиперволемии сосудов легочной артерии, увеличены правые отделы сердца, определяется пульсация корней легких. Катетеризация полостей сердца позволяет выявить сброс крови на уровне предсердий. При операции производят ушивание дефекта или пластику его заплатой в условиях ИК.
Из особенностей анестезии следует учитывать наличие у больного гиперволемии малого круга кровообращения. Эффект ингаляционных анестетиков проявляется быстрее, что требует тестирования и более четкой дозировки анестетиков при поддержании анестезии. При ушивании небольшого дефекта межпредсердной перегородки без применения кардиоплегии важным аспектом профилактики воздушной эмболии через дефект является согласованность действий анестезиолога и хирурга в момент наложения швов на края дефекта. В течение всего периода ушивания дефекта следует поддерживать постоянно повышенное давление в воздухоносных путях с помощью мешка наркозного аппарата. Это позволяет обеспечить наполнение кровью полости левого предсердия таким образом, чтобы, с одной стороны, кровь не заливала операционное поле и не мешала хирургу накладывать швы на дефект, с другой — полость левого предсердия была постоянно наполнена кровью, поступающей из легочных вен, что предупреждает попадание воздуха в левое предсердие. В связи с этим следует постоянно визуально контролировать процесс ушивания дефекта до момента достижения герметичности швов на перегородке. После коррекции порока давление снижается в правых отделах и несколько повышается в левом предсердии и в аорте. В ряде случаев могут наблюдаться довольно стойкие нарушения ритма, требующие применения электрокардиостимуляции в непосредственном послеоперационном периоде.
Атриовентрикулярный канал. Анатомически порок является сочетанием дефектов межпредсердной и межжелудочковой перегородок с патологией митрального и трикуспидального клапанов как следствие аномалии эмбрионального развития эндокардиальной подушки. Различают:
1) частично открытый атриовентрикулярный канал, первичный дефект межпредсердной перегородки с расщеплением створки митрального или трикуспидального клапана либо дефект межжелудочковой перегородки с патологией атриовентрикулярных клапанов;
2) дефекты атриовентрикулярной перегородки с частичным нарушением формирования атриовентрикулярных колец;
3) полный атриовентрикулярный канал при практически полном отсутствии межпредсердной перегородки, с нарушением формирования атриовентрикулярных колец и дефектом межжелудочковой перегородки [Kahn D et al., 1968]
Патофизиология порока характеризуется большим разнообразием. При неполной форме атриовентрикулярного канала имеет место митральная регургитация. Для полной формы канала типичны выраженные нарушения гемодинамики и раннее развитие легочной гипертонии. Шунтирование крови обычно направлено из левого желудочка в правое предсердие. При полном канале может отмечаться небольшой веноартериальный сброс за счет смещения крови в фактически едином предсердии.
Клинически пороку свойственны одышка, быстрая утомляемость, отстава; ние в физическом развитии, частые пневмонии в анамнезе. Нередко наблюдается деформация грудины, пальпируется систолическое дрожание. У больных с общим открытым атриовентрикулярным каналом над всей областью сердца регистрируется грубый систолический шум, имеющий форму ромба на фонограмме. При частичной форме атриовентрикулярного канала может прослушиваться систолический шум, характерный для межпредсердного дефекта справа от грудины и более грубый систолический шум во втором — третьем межреберье слева от грудины вследствие митральной недостаточности. На ЭКГ типичными признаками порока являются отклонения электрической оси сердца влево с признаками диастолической перегрузки правого желудочка и неполной блокадой правой ножки предсердножелудочкового пучка, замедление атриовентрикулярной проводимости, сочетание гипертрофии правого и левого желудочков. При полном атриовентрикулярном канале более выражены признаки гипертрофии правых отделов сердца. Ангиографически выявляются удлинение выходного отдела левого желудочка и его деформация, которая в левой проекции имеет характерную форму («гусиная шея») вследствие смещения и деформации митрального клапана [Baron M. et al., 1964; McCabe J. et al., 1977].
Коррекция наиболее распространенной формы порока неполного атриовентрикулярного канала состоит в ушивании расщепления переднемедиальной створки митрального клапана из полости правого предсердия и пластике дефекта с помощью заплаты.
Одной из основных особенностей коррекции порока является частое нарушение проводящих путей, что нередко требует довольно длительного применения электрокардиостимуляции в послеоперационном периоде.
Дефект межжелудочковой перегородки. Эмбриологически со 2го месяца внутриутробного развития начинается рост межжелудочковой перегородки из мышечноэндокардиального валика, появляющегося в области верхушки сердца. Перегородка растет снизу вверх, сливается с зачатками клапанов предсердножелудочкового отверстия и с перегородкой луковицы сердца. На 8й неделе внутриутробного развития отверстие в верхней части перегородки закры: вается соединительнотканной мембраной. Этому способствует постепенный поворот артериального ствола, при котором перегородка луковицы сердца и межжелудочковая перегородка оказываются в одной плоскости, после чего межжелудочковый дефект окончательно закрывается. Нарушение этих процессов приводит к образованию дефектов либо в мышечной, либо в мембранозной части перегородки сердца [Крымский А.Д., 1963; Lake С., 1985].
При изучении гемодинамики больных с дефектами межжелудочковой перегородки можно разделить на две группы. К первой относятся больные со сравнительно большими дефектами, с выраженным шунтированием крови в правые отделы сердца и гиперволемией малого круга кровообращения. Рано наблюдаются развитие вторичной легочной гипертонии и перегрузка правого и левого желудочков, которая обусловливает появление признаков декомпенсации кровообращения.
Вторую группу составляют больные с небольшими дефектами (0,5—1,5 см), умеренными нарушениями гемодинамики Наблюдается различной степени шунтирование крови через дефект. Легочный кровоток увеличен, однако легочная гипертония развивается только в более старшем возрасте и сердечная недостаточность, как правило, не возникает [Бураковский В.И., Иваницкий А.В., 1982]. Клиническая картина во многом зависит от величины шунтирования крови через дефект, степени выраженности легочной гипертонии и сердечной недостаточности. Характерно наличие грубого систолического шума, интенсивность которого обусловлена величиной дефекта и степенью шунтирования крови. По мере развития легочной гипертонии интенсивность шума может уменьшаться. На ЭКГ выявляются признаки перегрузки левых, а при гипертензии — правых и левых отделов сердца. Часто наблюдается отклонение электрической оси сердца влево. На рентгенограммах фиксируются умеренное увеличение левого и правого желудочков, усиление легочного рисунка.
Из особенностей анестезиологического обеспечения у этих больных следует отметить главным образом профилактику и лечение правожелудочковой недостаточности, которая может возникать при высокой легочной гипертонии. В последние годы в литературе стали появляться сообщения о применении простагландинов для контроля легочной сосудистой резистентности после коррекции порока [D’Ambra M. et al., 1985; Hickey P. et al., 1985]. Такие вазодилататоры, как простагландин EI или нитроглицерин, вводят капельно в легочную артерию в сочетании (в определенной пропорции) с норадреналином. Эффект этой смеси на легочную сосудистую резистентность определяется различным клиренсом простагландина в сосудах легких и норадреналина в периферическом сосудистом русле. В итоге снижается давление в правом желудочке и повышается его сократимость [Hickey P., 1986].
Открытый артериальный проток. Артериальный проток — это сообщение между левой ветвью легочной артерии и аортой дистальнее отхождения левой подключичной артерии. В норме проток функционирует у плода и закрывается после рождения, когда легочная сосудистая резистентность возрастает и легкие начинают функционировать. Если проток не закрывается, то возникает шунтирование крови через проток из аорты в легочную артерию [Kahn D. et al., 1968]. Дополнительное количество крови, поступающее из аорты в легочную артерию, вызывает гиперволемию сосудов легких, левого предсердия и левого желудочка. Гиперволемия в артериальной системе легких постепенно ведет к развитию склеротических процессов в легочных сосудах, нарастает легочная гипертензия.
Клинически определяются грубый систолодиастолический шум с максимумом звучания во втором межреберье слева от грудины («машинный шум»), акцент второго тона над легочной артерией. Систолическое артериальное давление несколько повышено, в то время как диастолическое может быть заметно снижено. На ЭКГ при значительном шунтировании крови регистрируются признаки перегрузки левого желудочка, а при нарастании легочной гипертензии выявляются симптомы перегрузки правых отделов сердца. При рентгенологическом исследовании наблюдаются усиление легочного рисунка за счет артериального русла легких, увеличение левого желудочка и левого предсердия в косых проекциях. Дуга легочной артерии выбухает. Катетеризация сердца позволяет установить повышенное насыщение крови на уровне легочной артерии и выявить степень гипертензии малого круга кровообращения. При аортографии обнаруживается сброс контрастного вещества в легочную артерию. Реже можно контрастировать проток и более точно судить о его величине. Осложнениями данного порока являются легочная гипертензия и бактериальный эндокардит.
Из особенностей анестезии при этом пороке следует отметить то, что может возникнуть необходимость в применении искусственной гипотонии как в периоде выделения протока, так и после перевязки его. Искусственная вазоплегия облегчает работу хирурга, уменьшает опасность возникновения кровотечения, снижает степень гипертензии в малом круге кровообращения, уменьшая тем самым нагрузку правого желудочка. Это имеет особое значение у больных с выраженной легочной гипертензией и при сравнительно широком протоке. Если проток короткий, широкий или со склерозированными стенками, то следует предусмотреть возможность внезапной массивной кровопотери и готовность к быстрому адекватному ее восполнению. После перевязки протока в ряде случаев может развиться острая сердечная недостаточность. В связи с этим перед лигированием протока производят пробное пережатие его и оценивают степень повышения давления в аорте и признаки сердечной недостаточности. В случае стабильности гемодинамики при пробной окклюзии протока его лигируют.
Из анестетиков наиболее часто используют фторотан в сочетании с закисью азота. В неотложных ситуациях с помощью фторотана удается достичь достаточной вазоплегии для выделения протока, снизить гиперволемию малого круга кровообращения и предупредить резкие гемодинамические сдвиги после лигирояания протока. В остальных случаях для искусственной вазоплегии целесообразно капельно вводить 0,1% раствор арфонада (триметофан) или гигрония, чтобы во время выделения протока и его перевязки поддерживать систолическое давление на уровне 70—80 мм рт. ст. В дальнейшем инфузию ганглиоблокатора постепенно прекращают и легкую вазоплегию поддерживают только с помощью фторотана. В послеоперационном периоде, если необходимо, вводят гигроний или пентамин. С целью вазоплегии используют и натрия нитропруссид. Однако следует учитывать одну его особенность. Эффект препарата исчезает сразу после прекращения инфузии, и наблюдается резкий подъем артериального давления, что весьма опасно в ближайшем послеоперационном периоде. Более целесообразно применять натрия нитропруссид в комбинации с арфонадом. Такое сочетание предупреждает увеличение артериального давления после инфузии смеси этих препаратов.
Коарктация аорты. Анатомически для этого порока типично сужение аорты в области ее перешейка, на границе дуги и нисходящего отдела аорты. Различают изолированное сужение перешейка аорты в сочетании с открытым протоком либо в сочетании с другими врожденными пороками сердца [Покровский А.В., 1966].