Клиническое применение кетамина началось с середины 60х годов и сразу вызвало поток противоречивых публикаций. В дальнейшем наступил период трезвой оценки и тщательного экспериментального и клинического изучения этого ценного по основным свойствам, но «трудного» для клинического использования анестетика, дающего массу центральных побочных эффектов. В результате двадцатилетних исследований уточнены механизмы нейрофизиологического действия кетамина, разработаны оптимальные методы его клинического применения. В современной анестезиологии кетамин занимает одно из ведущих мест.
Физикохимические свойства и фармакокинетика. Кетамин (С1581, кеталар, кетанест, кетажект, калипсол) представляет собой производное фенциклидина, близкое по химической структуре к галлюциногенам из ряда лизергиновой кислоты. Выпускается во флаконах по 10 мл 5% раствора, стабилизированного хлорбуталом. Водные растворы кетамина стабильны при комнатной температуре; их рН составляет 3,5 —5,5. Препарат хорошо переносим при внутривенном и внутримышечном введении. В нашей стране используется преимущественно калипсол фирмы «Гедеон Рихтер» (ВНР).
Кетамин обладает большой терапевтической широтой действия и ничтожной токсичностью, подтвержденными при длительном применении больших доз в эксперименте и клинике у больных с ожогами. После введения кетамин в силу хорошей жирорастворимости быстро попадает в мозг, а оттуда уже через 10 мин основная его часть перераспределяется в органы с хорошим кровоснабжением. С белками крови он связывается мало. Через 2 ч препарат разрушается в печени с образованием нескольких метаболитов, два из которых обладают каталептогенными свойствами, и в течение 2,5—4 ч выделяется с мочой и кишечным содержимым. Бензодиазепины удлиняют действие кетамина за счет торможения расщепления, галогеносодержащие анестетики — за счет замедления перераспределения из мозга [Larsen R., 1985].
Методика анестезии. Основной методический принцип анестезии кетамином — обязательная комбинация с другими фармакологическими компонентами, устраняющими его побочные эффекты. Лучшим базисным агентом для кетаминовой анестезии являются транквилизаторы бензодиазепинового ряда (диазепам), тормозящее действие которых направлено на возбуждаемые кетамином лимбические структуры мозга, ответственные за чрезмерные сердечнососудистые и психомоторные побочные эффекты кетамина. Средствами профилактики побочных реакций кетамина наряду с бензодиазепинами могут служить любые общие анестетики и препараты для нейролептаналгезии, но эти агенты значительно изменяют эффект кетамина, не позволяя в ряде случаев использовать его особые преимущества.
Для премедикации обязательно использовать транквилизатор типа диазенама (0,2 мг/кг), лучше в комбинации с дроперидолом (0,08 мг/кг). В большинстве случаев целесообразно применять атропин в общепринятой дозе, однако при исходно повышенной возбудимости миокарда, склонности к тахикардии и аритмиям, особенно у пожилых больных, снижение дозы атропина до 1/2—1/3 или полное его исключение из премедикации уменьшает либо полностью предотвращает кетаминовую тахикардию. Использование анальгетика в премедикации не обязательно, а при анестезии с самостоятельным дыханием нецелесообразно изза возможной депрессии дыхания во время анестезии.
Моноанестезия кетамином в настоящее время практически не применяется, так как даже у грудных и новорожденных детей она сопровождается симпатомиметическими сердечнососудистыми реакциями [Михельсон В.А. и др., 1981].
Анестезию начинают с внутривенного введения диазепама (0,2—0,3 мг/кг) в течение 1 мин. В большинстве случаев через 1—2 мин это приводит к развитию транквилизации средней или глубокой степени, после чего переходят к введению кетамина. При слабой индивидуальной реакции больного на диазепам целесообразно использовать дополнительный компонент — дроперидол (0,10—0,12 мг/кг) и через 3—5 мин после этого приступать к введению кетамина.
Клинический опыт свидетельствует о значительной вариабельности индивидуальной реакции на кетамин, поэтому одномоментное введение традиционной дозы (2 мг/кг), особенно старым пациентам, не оправдано. Первоначальная доза 0,5 мг/кг, вводимая со скоростью 1—2 мг/с, дает возможность оценить выраженность основного эффекта и уловить начальные признаки побочных симптомов, после чего продолжить введение анестетика, при необходимости приняв дополнительные меры (увеличение дозы диазепама, дроперидола).
Поданным специальных нейрофизиологических исследований, так называемая субанестетическая доза кетамина (0,5 мг/кг) может быть пригодна для достижения хирургической анестезии [Kochs E. et al., 1988].
У ряда больных, особенно пожилого возраста, для выполнения внеполостной операций достаточны дозы кетамина 0,8—1,0 мг/кг при гладком течении анестезии, адекватном самостоятельном дыхании и сумеречном сознании. В большинстве случаев оптимальная начальная доза составляет 1—1,5 мг/кг; поддерживающие дозы (1/2—1/3 первоначальной) вводят через 15—30 мин. При длительных операциях после начальной болюсной дозы производят непрерывную капельную инфузию 0,1% раствора кетамина в дозе 1,5—2 мг/(кг ч), сочетая ее с ингаляцией смеси закиси азота и кислорода (2:1) [Гологорский В.А. и др., 1985; Pedersen Т., 1981, и др.]. Инфузию препарата прекращают за 3040 мин до окончания операции. При особо травматичных операциях диазепамкетаминовую анестезию дополняют фентанилом и дроперидолом. Таким образом, анестезия становится многокомпонентной [Бунятян А.А. и др., 1981].
При соблюдении описанных методических приемов кетаминовая анестезия может быть успешно применена у любого контингента больных.
Клиническая и электроэнцефалографическая картина анестезии. В чистом виде кетамин вызывает бессознательное или ступорозное состояние, нередко при открытых глазах, резкое подавление болевой чувствительности, каталептический мышечный гипертонус, артериальную гипертензию, тахикардию, гиперсаливацию, галлюцинации и делирий, т.е. имеет сходство не с традиционными общими анестетиками, а с галлюциногенами типа ЛСД. Эти явления сопровождаются своеобразной картиной генерализованного гиперсинхронного вритма частотой 4—7 Гц на ЭЭГ (рис. 14.3, а, II). Такая форма электрической активности типична для возбуждения лимбических структур мозга (гиппокамп), а появление ее на ЭЭГ означает генерализацию этого возбуждения и распространение его на кору головного мозга. Описанная клиническая и электроэнцефалографическая симптоматика соответствует судорожному уровню возбуждения — так называемому лимбическому припадку. Естественно, что такой вариант общей анестезии не может быть приемлем для клиники, поэтому на практике кетамин не применяют без предварительной медикаментозной блокады лимбического комплекса бензодиазепинами. С учетом этого нами рассмотрена клиническая картина кетаминовой анестезии.
Как было показано выше, благоприятным фоном для введения кетамина является состояние диазепамовой транквилизации. Последняя сопровождается картиной ЭЭГ с преобладанием быстрых ритмов (14—22 Гц). Введенный в дозе 2 мг/кг в течение 1 мин кетамин обеспечивает спокойное развитие общей анестезии с выключением сознания, отсутствием реакции на внешние раздражители, без судорожных, психотических и вегетативных проявлений. Вместо типичного для моноанестезии кетамином вритма на ЭЭГ регистрируется быстрая активность в диапазоне 25—30 Гц (рис. 14.3, б, III). Дыхание и гемодинамические показатели остаются стабильными: гипертезия и тахикардия не развиваются, не возникает и гипотензия, вызываемая большинством других общих анестетиков. Примечательно, что у больных, не подготовленных атропином, кетамин не только не проявляет симпатомиметических свойств в отношении сердечной деятельности, но может способствовать развитию брадикардии, хорошо поддающейся коррекции атропином.
Действие кетамина как общего анестетика лучше всего можно оценить во время операций при самостоятельном дыхании больных, когда дефекты нейровегетативной защиты не маскируются искусственным выключением активной реакции больных с помощью тотальной мышечной релаксации. Принято считать, что кетамин более эффективно подавляет соматическую, чем висцеральную, чувствительность. Однако накоплен большой опыт успешного применения диазепамкетаминовой анестезии и при внутриполостных операциях, причем по степени защиты от операционного стресса этот вид анестезии превосходит традиционные [Шедлих М., 1979; Гологорский В.А. и др., 1985]
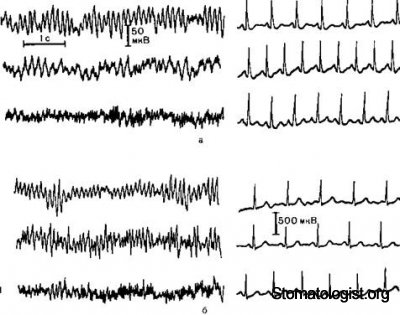
Рис 14.3 ЭЭГ и ЭКГ при анестезии кетамином в сочетании с диазепамом.
а – внутривенное введение сначала кетамина а затем диазепама; I фон: аритм частотой 9,5 Гц, частота сердечных сокращении 98 в минуту, II – при введении кетамина в дозе 2 мг/кг преобладание Вритма частотой 5,66 Гц, увеличение частоты сердечных сокращении до 135 в минуту; III – при введении диазепама в дозе 0,25 мг/кг переход к быстрой электроэнцефалографической активности (20—25 Гц) и нормализация частоты сердечных сокращении; б – внутривенное введение сначала диазепама, а затем кетамина; I — фон и ритм частотой 105 Гц частота сердечных сокращении 75 в минуту; II — при введении диазепама в дозе 0,25 мг/кг преобладание электроэнцефалографической активности частотой 1418 Гц, частота сердечных сокращении без изменении; III при введении кетамина в дозе 2 мг/КГ увеличение частоты биопотенциалов коры головного мозга до 2025 Гц, частота сердечных сокращении 85 в минуту.
Аналгезия развивается спустя 1—2 мин после внутривенного введения кетамина и продолжается 1020 мин, тогда как сознание может возвращаться раньше, поэтому нередко во время операции возможен словесный контакт с больны¬ми хотя впоследствии они об этом не помнят благодаря развивающейся ретро¬градной амнезии. Кетамин можно рассматривать как истинный анальгетик, что является его большим преимуществом. При ослаблении аналгезии возникают реакция в виде учащения дыхания, повышения артериального давления и часто¬ты сердечных сокращений, двигательная и словесная реакция. В течение не¬скольких часов после операции в условиях кетаминовой анестезии аналгезия сохраняется на достаточном уровне и нет необходимости в дополнительном обез¬боливании. Выход из кетаминовой анестезии обычно бывает спокойным. При нарушении оптимальной методики выход из кетаминовой анестезии может осложниться психомоторным возбуждением, галлюцинациями, бредом.
Действие на организм. Для объяснения механизма действия кета¬мина на ЦНС предложены две концепции концепция «диссоциативной анесте¬зии», предложенная G. Corssen и соавт. (1968) (активация лимбических струк¬тур, обусловливающая побочные симптомы кетаминовой анестезии, при торможении таламоретикулокортикальной системы, обеспечивающем анестезию), и концепция М.И. Кузина и соавт (1973), W Winters (1972) и др., отрицаю¬щая диссоциацию в действии кетамина и рассматривающая его как средство, приводящее к возбуждению всех структур мозга, включая кору, с вторично развивающимся снижением реактивности на болевую импульсацию. Однако бесспорным для обеих концепций является экспериментально обоснованный факт чрезмерного возбуждения лимбических структур, требующего устранения бензодиазепинами, после чего течение кетаминовой анестезии становится стабильным, с минимальным риском побочных эффектов. Анальгетическое действие кетамина как деривата фенциклидина реализуется, вероятно, через опиатные сигмарецепторы [Звартау Э.Э., 1986].
Действие кетамина на кровообращение носит характер симпатотонического сердечнососудистого криза и проявляется резким увеличением артериального давления, ЦВД, частоты сердечных сокращений, работы левого желудочка, коронарного и периферического кровотока, легочного сосудистого сопротивления, потребления миокардом кислорода при одновременном снижении ударного индекса и общего периферического сопротивления [Гологорский В.А. и др., 1979, и др.]. Мозговой кровоток и внутричерепное давление под действием кетамина возрастают, но потребление кислорода мозгом не меняется [Larsen R., 1985]. Наиболее вероятной причиной стимуляции кровообращения кетамином является активация центральных адренергических механизмов [Larsen R., 1985]. Все гемодинамические эффекты кетамина предотвращаются или их выраженность значительно уменьшается с помощью диазепама, общих анестетиков, высокой эпидуральной анестезии или фентоламина.
Способность кетамина стимулировать кровообращение удачно используется у больных в состоянии шока.
Действие кетамина на дыхание в сравнении с большинством общих анестетиков минимально. На фоне диазепамкетаминовой анестезии в установленных дозах и в отсутствие превышения скорости введения препаратов дыхание обычно остается адекватным, мышечный тонус и защитные рефлексы верхних дыхательных путей сохранены, поэтому вероятность аспирации при анестезии с самостоятельным дыханием минимальна. Секреция слюны и трахеобронхиальных желез без комбинации кетамина с тормозящими ее средствами (атропин, дроперидол, диазепам) повышена.
На функцию печени и почек кетамин не влияет, аллергических реакций не вызывает. Он не только не повышает концентрацию гистамина в крови, но приводит к ее снижению, особенно у сенсибилизированных больных, и дает эффект при экспериментальном гистаминовом шоке [Колосов М.М., 1981]. Кетамин оказывает незначительное действие на иммунную систему организма и может применяться у больных с первичной и вторичной недостаточностью иммунной системы [Гадалов В.П., 1985].
Показания. Кетамин особенно показан и не имеет себе равных при анестезии с сохраненным самостоятельным дыханием при внеполостных и малых внутриполостных (аппендэктомия) операциях, малых гинекологических вмешательствах, хирургической обработке ожоговых поверхностей, для индукции общей анестезии у больных в критическом состоянии, у неконтактных детей (внутримышечно), является средством выбора у больных с отягощенным аллергологическим анамнезом. Эффективен как средство устранения острого болевого синдрома (0,2—0,5 мг/кг внутривенно). Является действенным компонентом любой комбинированной анестезии.
Противопоказания: эпилепсия, психические заболевания, феохромоцитома, повышение внутричерепного давления, тяжелая сердечная недостаточность, гипертоническая болезнь. При правильной методике кетаминовой анестезии указанные сердечнососудистые заболевания не являются абсолютным противопоказанием.